荧光成像脱落在细胞凋亡上
每秒钟,我们体内大约有100万个细胞因细胞凋亡而被破坏,并被新的细胞取代。这一“细胞自杀”的过程对于维持我们的细胞稳态和身体健康至关重要,在胚胎学、生理和病理条件中起着重要作用。在病理条件下,细胞绕过凋亡,本质上超过了它们的“使用期限”,并可以通过致癌改变成为致瘤或癌变。在这些情况下,化疗和抗癌药物被用来诱导细胞凋亡,防止进一步的肿瘤增殖,目的是治愈患者。细胞凋亡是抗癌药物治疗后的一个治疗目标。为了确保这些药物正常工作,研究人员和卫生从业人员能够准确识别和量化凋亡细胞是至关重要的。虽然目前存在几种方法,但大多数需要昂贵和复杂的设备和程序,如低温显微镜,难以置信的高分辨率显微镜或专门的共聚焦显微镜。此外,这些方法使用的是处理过的细胞样本,而不是活培养,不能在标准的实验室设置下实时逐事件地显示药物诱导凋亡过程中的作用机制。
南达科他州阿韦拉癌症研究所的南迪尼·戴伊博士、普拉迪普·德博士和詹妮弗·卡尔森·阿斯克女士改变了这一现状。这个研究小组花了多年时间研究抗癌药物及其作用方式。特别是,他们的兴趣在于肿瘤细胞对治疗反应的行为,而细胞凋亡是他们实验室的主要重点领域之一。本小组建立的方法基于事件识别活细胞的凋亡现象,使他们能够监测细胞中常规化疗药物、靶向治疗药物和免疫治疗药物等抗癌药物治疗后的凋亡细胞。

为了改善活细胞凋亡的识别,Avera癌症研究所团队开发了一种具有成本效益和用户友好的方法来实时可视化活细胞凋亡背后的物理和生化过程。该团队最近发表在《科学报告》上,表明这种独特的工具可以确定抗癌药物的疗效,并有潜力确定新的药物靶点。这种方法的新颖之处在于,它以实验室友好的方式确定了细胞凋亡的三个顺序的主要生化、酶和形态学事件。
细胞凋亡是什么?
在危机时期,你会牺牲一个拯救许多人吗?这就是我们的细胞所做的:如果它们遭受无法弥补的DNA损伤,它们是遗传地编程为“自我毁灭”,保护身体免受进一步的伤害。这种“编程的细胞死亡”称为细胞凋亡。细胞凋亡是癌症的标志。它涉及由染色细胞控制的某些形态学,生物化学和生理序贯步骤。细胞凋亡的特点是细胞收缩的物理迹象,舍入,核收缩和核膜完整性,血浆膜膨胀,核碎裂,最后,细胞碎片。

Apoptotic cells also undergo a series of biochemical changes including executioner caspase activation, mitochondrial membrane alterations and release of a protein called cytochrome C, externalisation of phosphatidylserine – an ‘eat me’ signal for scavenging macrophages – to the cell surface, poly (ADP-ribose) polymerase (PARP) cleavage and nuclear DNA fragmentation.
通过跟踪这些良好调控和顺序的过程,研究人员可以观察到抗癌药物治疗对肿瘤细胞的凋亡效应,并可能识别新的药物靶点。这就是戴伊博士和她的团队研究的切入点。

从新的角度看细胞凋亡
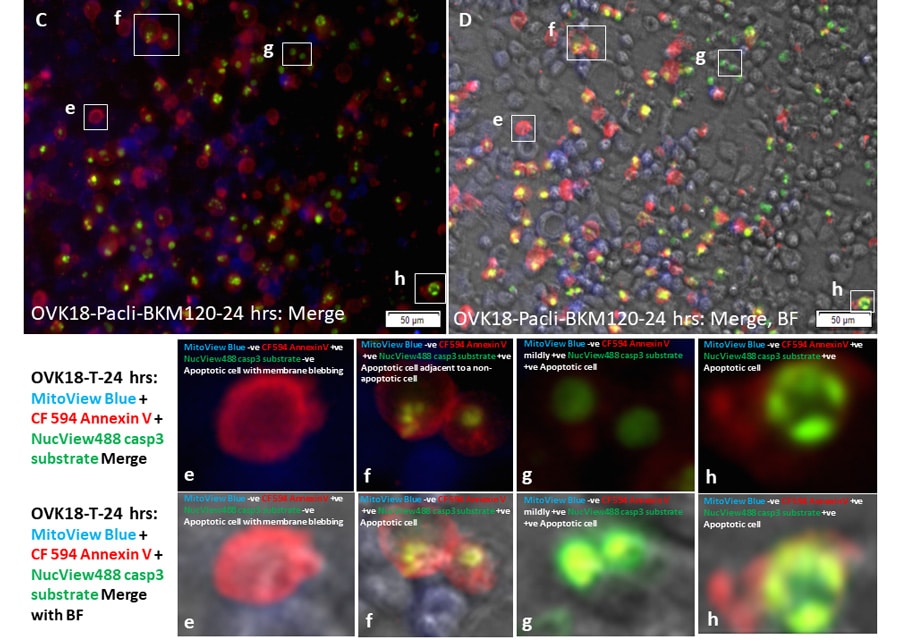
利用荧光显微镜和三种荧光染料(荧光团),Avera癌症研究所团队将活细胞中这三种顺序发生的凋亡速率限制特征结合起来。在他们的“三重荧光染色”中,他们可以观察活卵巢癌细胞中执行子caspase 3(绿色荧光团)的酶活性、磷脂酰丝氨酸的外部呈现(红色荧光团)和线粒体功能的改变(蓝色荧光团)。
为了诱导卵巢癌细胞凋亡,研究小组使用名为紫杉醇(常规化疗药物)和BMK120(靶向pan PI3K抑制剂)的抗癌药物或单独或联合治疗两种卵巢癌细胞系OVK18和A2780。然后将这些细胞的荧光模式与未处理的细胞进行比较。在显微镜下检查时,研究人员发现,大多数未处理的细胞发出亮蓝色的荧光,因为它们的线粒体仍然完好无损。相反,处理后的细胞发出绿色和/或红色的荧光。这是预期的,因为caspase 3起始和磷脂酰丝氨酸呈现只发生在凋亡过程中。
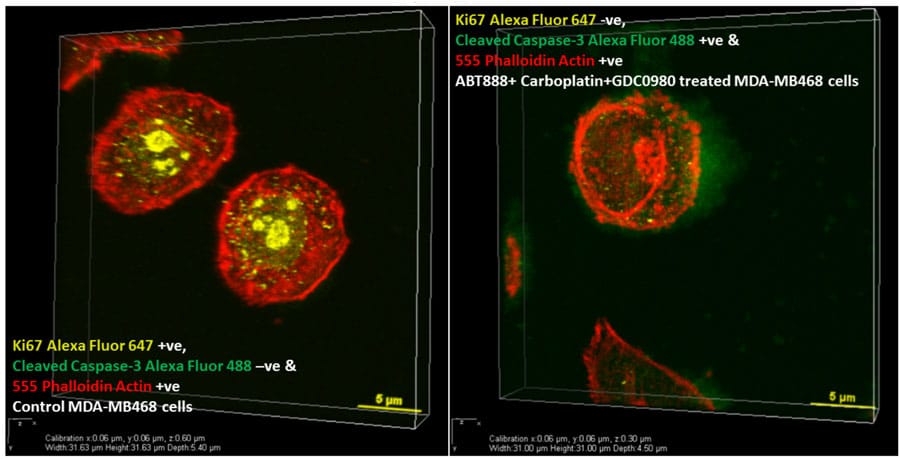
电影#1:控制MDA-MB468细胞免疫荧光:共聚焦图像(重组z切面)的3d投影电影显示,72小时后,载药处理的MDA-MB468细胞中核Ki67(黄色)丰富,胞质cleaved caspase 3(绿色)缺失。肌动蛋白丝染成红色。MDA-MB468细胞被Ki67(黄色)和Cleaved Caspase3(绿色)双染色。细胞Ki67阳性,Cleaved Caspase3阴性。肌动蛋白被染色为结构蛋白质。
电影#2:GDC-0980 + ABT888 + Carboplatin处理的MDA-MB468细胞中免疫荧光:来自共聚焦图像的3D投影电影(重构的Z部分)显示在72小时内显示出在GDC-0980 + ABT888 + Carboplatin处理的MDA-MB468细胞中的核ki67(黄色)和细胞质切割的胱天蛋白酶3(绿色)的存在。肌动蛋白丝染成红色。MDA-MB468细胞被Ki67(黄色)和Cleaved Caspase3(绿色)双染色。细胞对于Ki67是阴性的,并且用于切割的Caspase3的阳性。肌动蛋白被染色为结构蛋白质。
验证概念
为了确保抗癌药物对这些凋亡效应负责,研究人员用不同剂量的紫杉醇或紫杉醇和BMK120对卵巢癌细胞进行处理,并在不同的放大率和不同时间点上成像。
不出所料,紫杉醇处理的OVK18细胞增殖减少或停止,这取决于给药剂量,48小时后开始凋亡,同时凋亡标记物的表达。此外,与未处理的样本相比,这些样本总体上有更多的死亡细胞。在紫杉醇和bmk120处理的OVK18细胞中也发现了类似的结果,48小时后开始凋亡,但这一次,线粒体活性的变化首先出现在24小时。
紫杉醇治疗的A2780细胞达到最长的凋亡状态,该过程发生在处理后48和72小时。然而,治疗后24和48小时发生线粒体活性的变化。该样品还具有比未处理的样品更多的死细胞,证明紫杉醇导致细胞死亡,因此验证显微镜结果。因此,使用本协议,该组成功地确定了诱导细胞凋亡中的药物作用的时间和最终模式。
识别Live和Dead细胞
为了识别活的和死的细胞,Dey博士和她的小组用一套新的荧光团处理了他们的样本。死细胞发出红色荧光,活细胞发出绿色荧光。流式细胞仪检测线粒体电位,荧光显微镜下观察活死细胞。使用“活细胞和死细胞实验”的荧光成像比较显示,在处理和未处理的样本中,红色(死)细胞和绿色(活)细胞没有重叠。
相反,使用其“三荧光染色测定”的荧光成像比较显示在处理和未处理的样品中的红色(膜蛋白v阳性凋亡细胞)和绿色(活性Caspase3阳性凋亡细胞)重叠;这是因为绿色细胞和红细胞处于细胞凋亡的不同阶段。在蓝色和红色和/或绿色细胞之间没有观察到重叠,并且是预期的,因为具有活性线粒体的蓝细胞不太可能表现出细胞凋亡,而红色和/或绿色或红色和绿细胞均不太可能表现出函数蓝线粒体。然而,有趣的是,一些药物处理的细胞仍然显示线粒体活性(蓝荧光)。
为什么这很重要?
虽然并非所有这些生化过程都具有特异性细胞凋亡和凋亡事件是阶段,时间和刺激依赖性的,但三荧光染色方法的强度在于其易用性及其同时染色三种临界形态和临界形态的能力生化凋亡步骤 - 准确识别凋亡与非凋亡细胞更容易。相比之下,大多数现有技术依赖于一种凋亡(但不一定是凋亡特异性)特征来鉴定和量化这些细胞。此外,三重荧光染色可以实时地显示活细胞中的凋亡过程 - 允许研究人员参见抗癌药物的作用机制及其疗效。

这种实验室友好的方法可以标准化,只需极少的实验室设备和资源,使其成为一种相对廉价和可获得的方法,可以应用于任何相关的药物治疗。值得注意的是,它已经被用于观察不同药物组合对其他肿瘤细胞系的影响。该实验的优势在于它能够以事件为基础的方式识别促凋亡药物的作用模式。
个人反应
为什么在“活细胞和死细胞实验”中有些细胞会显示红色和蓝色?
你看到这项研究的未来是什么?
虽然目前该协议被验证并用于翻译肿瘤学中,但我们认为该程序将有意义地适应其他领域的细胞凋亡。例如,细胞凋亡现象是发育生物学,再生医学和干细胞研究领域的关键事件。我们想象,帕金森病,阿尔茨海默病,心肌缺血,心肌梗塞和创伤诱导的细胞凋亡的研究将有机会有效地使用本协议。

