致癌作用:当表观遗传信息传递出错时
虽然我们都以每个父母的半基因组作为一个细胞,但是单细胞快速分开,创造了新细胞并彼此不同。该细胞分化的该方法使多细胞生物能够包含数百种不同的细胞类型,每个细胞类型能够进行专用功能。最初认为这些差异是从受精卵中遗传物质损失的结果。然而,移植研究表明,每个细胞只表达了其总曲目中的基因比例,并且答案在于每个细胞部署其基因组的方式。表观遗传学是细胞指定某些基因使用的过程和其他用于储存的过程。从本质上讲,表观遗传变化允许细胞调节其基因表达而不永久地改变基因本身。
推动我们对Epigenetics迷人领域的知识的界限是Patrick Riley,伦敦大学学院的细胞病理学emeritus教授。Riley教授表明,表观遗传信息的体细胞遗传缺陷为癌症的发展和特征提供了解释。
开启和关闭基因
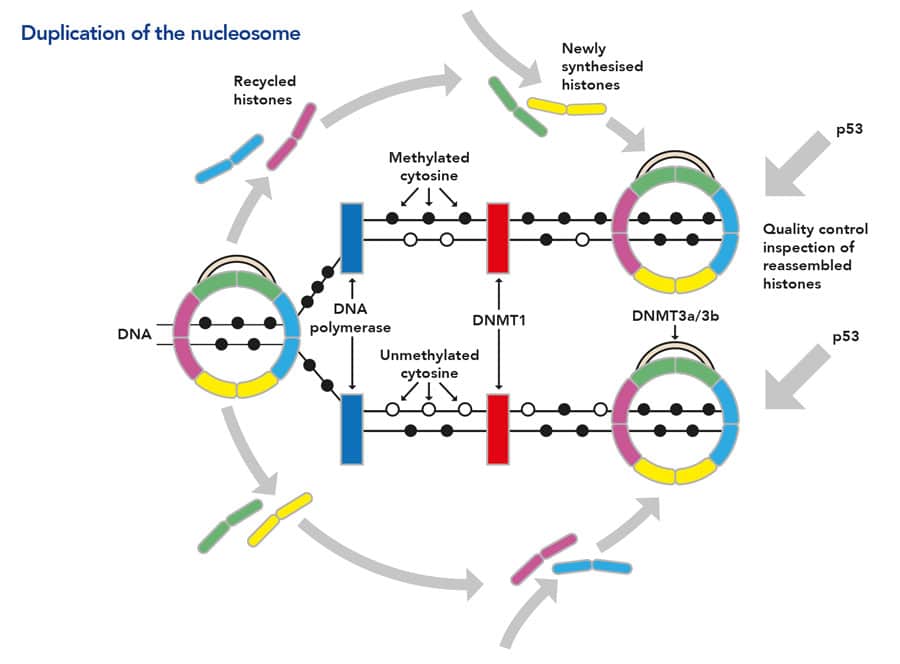
分化的过程包括基因沉默,依赖于组成染色体的DNA复合体的微小的、可逆的变化;包括DNA甲基化和组蛋白修饰。在细胞内,DNA片段紧密地包裹在称为组蛋白的蛋白质周围,形成核小体。反过来,核小体被串在一起形成染色质,这是构成染色体的纤维。这种紧密排列的线圈提供了一种严格控制基因活性(或基因表达)的方法。
赖利教授认为,表观遗传的缺陷为致癌提供了一种解释。
要激活一个基因,包含该基因的那部分DNA必须是可接触的。组蛋白控制着DNA排列的紧密程度,从而也控制着遗传信息的可读性。松散的核小体(如常染色质)允许DNA转录和基因表达。相反,紧密排列的核小体(如异染色质)阻止转录机制的进入,因此这些DNA片段上的基因被沉默。基因沉默的主要方式是将甲基群附着到DNA分子的特定胞嘧啶碱基上。对部分DNA的修饰决定了DNA与组蛋白结合的方式,从而调节哪些基因能够被表达。甲基等表观遗传标记使细胞保持笔直和狭窄——确保它们以有序的方式分裂并保持其本性(例如,肾细胞仍然是肾细胞)。
保留现状
为了使基因表达的正确模式延续,至关重要的是,在每个细胞分裂时(当DNA被复制时),也会复制特定的甲基化模式。也就是说,必须准确地复制DNA甲基化到新制造的重复DNA(即正确传播基本表观遗传信息)。由于DNA的甲基化模式最终决定了染色体结构,因此DNA甲基化的任何缺陷复制可能导致改变的染色体结构,导致先前沉默的基因的不适当表达(例如胚胎发育期间表达的那些)或先前的表达失败活性基因。
容易出错的表观遗传继承
在2014年出版物中,Riley教授提出了致癌物可能是涉及涉及表观遗传信息的缺陷的过程的结果,在1979年通过Holliday建议的一个想法建立了一个想法1.该概念被视为对癌症主要特征的理性解释,包括染色体结构的紊乱和功能,以及类似于超矫正性的基因表达的可变和异常模式。

恶性细胞的关键特征是异常的迁移行为,正如赖利教授解释的那样:“那些细胞壁阻止迁移的植物不会得癌症。”在动物中,细胞迁移是胚胎发育的重要特征,但在成体中受到严格限制。”他指出,正常情况下与发育相关的迁徙行为的任何缺陷表达都将是灾难性的,特别是如果它是正常基因的计划外表达的结果,因为这将不被免疫系统识别。
莱利教授还观察到,癌症不会发生在未分裂的细胞中,这表明关键的遗传错误只会在DNA复制过程中出现,如果它们是由表观遗传复制的保真性失败造成的,情况也会如此。
确认观测
其他人的研究与莱利的猜想一致。所有的癌症都显示异常的DNA甲基化模式,它们显示可变和异常的基因表达,以及染色体异常。此外,有研究表明,在组织中发生恶性变化的可能性与干细胞的数量有关,并与干细胞生长和增殖的速率成比例。
赖利教授认为,异常的质量控制系统是恶性肿瘤的一个重要因素。
有趣的是,大多数成人癌症和儿童癌症(发育性恶性肿瘤)之间存在差异。然而,它们都可以用表观遗传起源的概念来解释。发育性癌症似乎是由于分化失败引起的。正如赖利教授解释的那样:“儿童癌症起因于缺乏初始DNA甲基化,这是沉默某些基因所必需的,这些基因会对发育中的有机体组织施加限制性的遗传模式。”在这些情况下,恶性行为的成因似乎取决于未能启动适当的表观遗传模式,而不是未能使其永久存在。”
易出错的表观遗传传播的可能来源
莱利教授目前的研究重点是找出可能导致表观遗传传递缺陷的过程,特别是DNA甲基化缺陷的过程。甲基对DNA的添加在几个不同的水平上受到控制,并由一种称为DNA甲基转移酶(DNMTs)的酶家族进行。一种特殊的酶DNMT1至关重要,因为它能识别半甲基化的DNA链。在分化干细胞的DNA复制过程中,甲基化模式是由DNMT1复合物维持的,它将新合成的DNA链甲基化。另一个重要步骤涉及核小体的重组和正确的组蛋白的合并。这些重组结构决定了在正确甲基化模式复制中重要的相关酶复合物(如方案1所示)。很明显,在这个复制过程中,有几个步骤可能会因启动突变而出现缺陷,例如,通过影响DNMT1活性的突变。
质量控制机制
癌细胞中一个常见的缺陷涉及失活的p53。p53作为“安全网”,防止异常细胞发展成肿瘤,是在超过50%的癌症中检测到的最常见的突变。Riley教授提出了一个有趣的想法,即p53系统可能被视为“表观基因组的守护者”,这表明它的功能之一是检测分化细胞分裂产物的表观基因组之间的差异。那些被检测为异常的细胞将通过凋亡(受控细胞死亡)来消除。实际上,p53保护了表观遗传模式的准确转移,从而保留了基因表达和沉默的分化模式。
未来:表观遗传治疗?
如果所提出的癌变模型是正确的,起始病变包括影响表观遗传复制机制的一个或多个组成部分的突变,并且能够逆转缺陷过程可能是不现实的;但是,我们有可能设计出一种能够敏感地检测异常的分裂后甲基化模式的药物,从而开发出具有独特靶向性的细胞毒疗法。
然而,鉴于p53的“把关人”功能的明显重要性,通过引入该基因的额外副本,特别是在高危个体中,可能有预防治疗的余地。有证据表明,大象的癌症发病率相对较低是由于p53基因的多重复制。
1Holliday R.(1979)癌症发生的新理论。Br J癌症;40:513 - 522。
个人反应
逆转表观遗传变化的药物对各种癌症具有激动的潜力。我们在实现这一实现有多远?
目前,最有希望的治疗进展似乎在免疫学领域,并且有趣的发展可能是将强大的抗原分子对能够检测异常甲基化DNA的试剂,从而将免疫系统提示给任何外观缺陷的细胞。

