如何制作CRISPR奶牛
几个世纪以来,育种者已经选择了展示所需品质的动物,以成为下一代的父母。当育种者基于可见特性选择动物时 - 例如,涂层颜色 - 它们实际上是在对个体之间的差异差异的DNA序列中的天然存在的变化之间选择。
使用传统育种,实现预期的变化可能需要几十年。这对于像牛这样的大型牲畜来说尤其如此,因为它们的世代间隔很长。基因组编辑技术的进步提供了一个机会,可以更快地带来有用的变化。在这个过程中,特定的DNA序列变异可以直接插入到牲畜基因组中。
一种常用的基因组编辑方法是CRISPR/Cas9系统。这个系统有两个组成部分。切割DNA的Cas9蛋白,以及引导Cas9切割位置的引导分子。它们结合在一起,形成一个复合体,在目标位置切割DNA。由此产生的断裂被称为DNA双链断裂(DSB),然后由细胞的自然DNA修复机制修复。


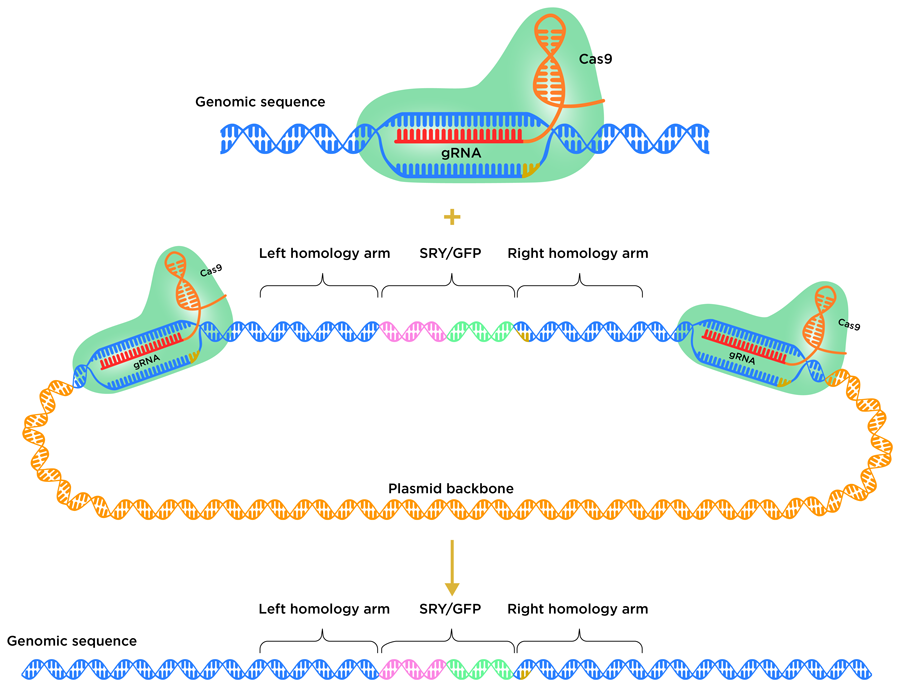
细胞使用不同的自然机制来修复dsb。非同源端连接(nonhomologous end joining, NHEJ)途径和同源定向修复(homologydirected repair, HDR)途径是两种可能的修复途径。NHEJ通常会在剪切位点附近导致短时间的插入/删除事件(微小的DNA片段被插入或从基因组中删除)。另外,HDR也可用来从供体模板中引入有用的DNA序列。HDR供体修复模板通常包含要插入的DNA片段或基因,两侧有同源臂。这些臂反映了CRISPR靶位点两侧的DNA序列。到目前为止,利用胚胎中的HDR途径将整个基因插入到牲畜基因组中是非常困难的。
为了避免新基因的插入被细胞的DNA修复系统所阻碍,该团队采用了同源性介导的末端连接(HMEJ)策略。
最近,一个由加州大学戴维斯分校的Alison Van Eenennaam博士和博士生Joseph Owen领导的团队,在早期的牛胚胎中使用CRISPR-Cas9系统来产生一只携带靶向插入的小牛对不起基因。这只小公牛名叫Cosmo,出生于2020年4月COVID-19大流行期间。Cosmo的独特之处在于他还携带着绿色荧光蛋白基因的副本。用荧光作为标记来识别携带目标基因的胚胎对不起基因插入。这些胚胎随后被转移到代孕奶牛身上,其中一头随后产下了Cosmo。
为什么这种基因?
的对不起基因携带称为性别测定区域Y的蛋白质的指示,这些区域涉及男性性发育。具体地,该蛋白质充当转录因子,这意味着它与DNA的特定区域附着,有助于控制特定基因的活性。该蛋白质开始导致胎儿进行胎儿的过程(睾丸)并防止女性生殖结构(子宫和输卵管)的发展。继承对不起基因使胚胎发育成男性。能够生出全雄后代的公牛是肉牛养殖者的理想选择;以同样的方式,奶牛饲养者也希望所有的后代都是雌性的。
设计指南
作为插入的第一步对不起基因导入胚胎后,该团队开发了一种引导RNA。这种引导RNA(单链核酸,而DNA是双链)引导Cas9蛋白在牛17号染色体上的一个特定位置切割。这个位点,H11,是一个已知的“安全港”,这意味着在这个位置的基因插入不会破坏必要的基因。该团队预测,指南将指导Cas9在目标H11位点切割,而不是在其他位置,因为它不匹配任何其他牛DNA序列。这种设计有助于确保Cas9不会在基因组的“脱靶”位置被切断。该指南对目标序列进行了测试体外,在活的有机体内在牛细胞系中,以确保它指导Cas9有效地将DSB引入H11靶位点的DNA中。
时间就是一切
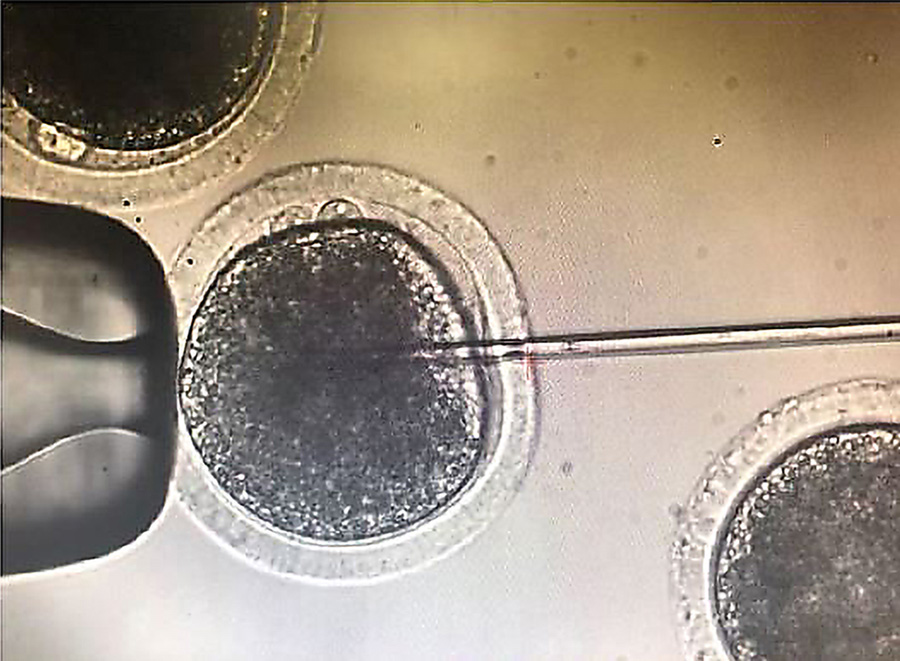
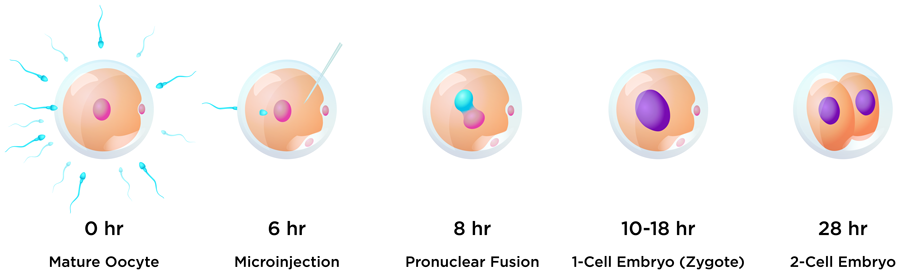
这项研究的目的之一是在受精后立即编辑早期胚胎,以避免所谓的基因嵌合现象。当从一个受精卵发育而来的个体内存在两组或两组以上不同基因型的细胞时,就会发生嵌合现象。这种情况通常发生在胚胎在第一次细胞分裂之前开始复制自己的DNA期间或之后。为了避免在这项研究中出现嵌合现象,在授精后6小时,DNA合成开始之前,将引导剂、供体和Cas9蛋白编辑试剂引入牛胚胎中。对于希望将基因插入胚胎的研究人员来说,这个时机的挑战之一是要避开细胞的主要DNA修复途径。在胚胎发育的早期阶段,修复倾向于通过NHEJ途径,而早期胚胎的HDR编辑效率非常低。
世界上第一只由crispr介导的HMEJ敲入早期胚胎的公牛在出生时重110磅(50公斤)。
一个插入的策略
为了避免新基因的插入被细胞的DNA修复系统所阻碍,该团队采用了同源性介导的末端连接(HMEJ)策略。在这个过程中,HMEJ供体模板被设计成同源臂在CRISPR靶序列的两侧。这种基于hmej的方法已被证明在早期1细胞胚胎中是有效的,其基因插入效率远远高于基于hdr的替代策略。插入的对不起该团队设计了一个HMEJ供体模板,H11 CRISPR靶序列位于同源臂的两侧。
然而,使用这种方法插入仍然不是100%的效率。在最初的实验中,只有大约40%的牛胚胎被发现具有对不起插入。牛胚胎移植以及随后9个月的妊娠都很昂贵。这意味着该团队需要在胚胎转移到代孕奶牛之前确认基因插入是否成功。其中一种方法是使用胚胎活组织检查,从胚胎中取出一些细胞,然后检查植入的细胞是否存在对不起基因。不幸的是,这一过程会降低胚胎的生存能力,特别是如果胚胎随后被冷冻以便日后移植。
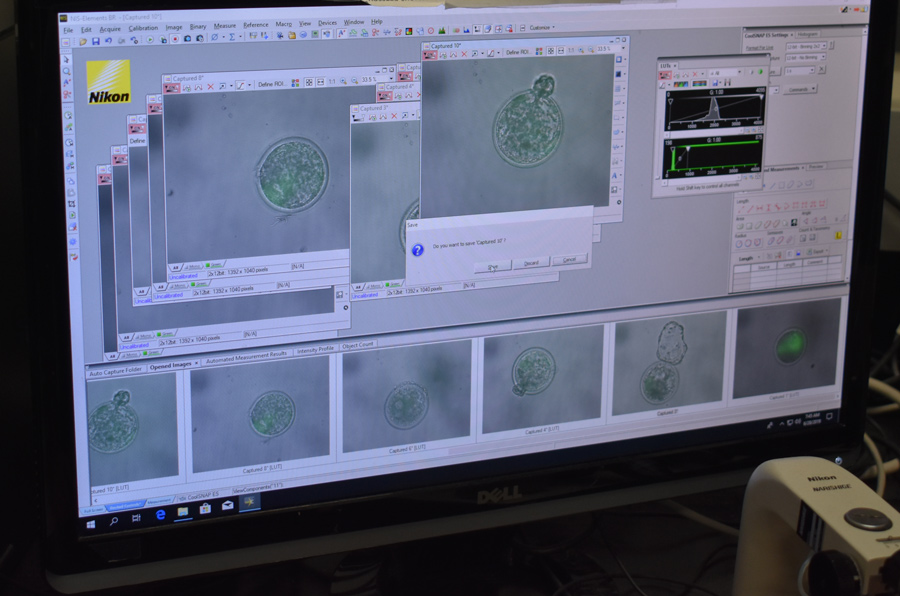
该团队选择了不同的筛选方法:“记者”基因。报告基因易于易于识别的特征 - 荧光,例如 - 允许胚胎的非侵入性筛选。在该实验中,包括水母绿色荧光蛋白(GFP),包括在内对不起,坐在HMEJ供体模板上的同源臂之间。荧光蛋白引起任何胚胎对不起插入时,当暴露在紫外线范围的蓝光时,发出绿色的光。对胚胎进行了筛选,2019年6月,9个在紫外线下发出绿色荧光的7天胚胎被转移到代孕奶牛身上。一个月后,其中一头母牛,3113,被证实怀孕了,超声波扫描显示她怀的是一头公牛犊。
Cosmo的到来
9个月后,在COVID-19大流行期间,Cosmo登场了。世界上第一只由crispr介导的HMEJ敲入早期胚胎的公牛在出生时重110磅(50公斤)。研究小组能够对这头小牛进行详细的基因分析。他们发现Cosmo有好几份GFP:对不起基因在17对中的一个,另一个染色体。这表明,当Cosmo是一个新成形的胚胎时,Cas9在一个染色体17上的H11轨迹引入的Cas9的DSB被NHEJ修复,导致小26个碱基对插入,并且使用HMEJ-供体模板修复另一个。生产多个GFP.和对不起基因插入和供体质粒骨架的副本。
团队希望,未来有一天,COSMO将成为一个父亲。Cosmo的未来后代应该揭示一些有趣的东西:将继承几份的副本对不起基因导致牛的XX胚胎(正常情况下是雌性)发育成雄性小牛?当然,Cosmo仍然携带着绿色荧光报告基因的几份拷贝。然而,如果没有一个巨大的黑暗的迪斯科舞厅,Cosmo可以暴露在紫外线范围的蓝色光线下,研究人员可能永远无法把Cosmo想象成一个发光的“绿牛”。
个人反应
这是一个迷人的故事。您的研究的后续步骤是什么?
这个项目突出了与大型牲畜合作的一些复杂性。未来分析XX后代的遗传情况对不起第17号染色体上的基因将揭示牛是否遗传对不起基因足以触发牛的雄性发育途径。2-3年的牛代间隔意味着我们要花好几年才能确定Cosmo的后代。
我们正在研究提高基因组编辑效率的方法,使用电流,而不是微注射,将编辑试剂引入牛胚胎中。我们希望这将提高编辑过程的效率,并提高编辑胚胎的存活率。
另一个复杂的问题是目前对基因编辑牲畜的调控方法。在美国,通过基因编辑引入动物的故意基因组改变被当作兽药来管理。这意味着它们在进入商业之前必须经过多代的安全性和有效性评估,这对于小型公司和研究大型牲畜物种的学术研究人员来说可能会变得非常昂贵。

